Colagenase
O que é uma colagenase?
A colagenase é uma enzima capaz de quebrar o colágeno. Como as colagenases quebram os vínculos, elas pertencem ao grupo das proteases. Como toda enzima, a colagenase também consiste em uma série de aminoácidos. Essas cadeias de aminoácidos são dobradas e, em última análise, sempre têm uma função específica.
A função da colagenase é quebrar as ligações entre dois aminoácidos. Um desses aminoácidos é sempre prolina, enquanto o segundo pode variar. Como o colágeno é composto de uma grande quantidade de prolina, ele é decomposto pelas colagenases e, finalmente, decomposto.
No total, existem cinco colagenases diferentes em humanos, cada uma especializada em diferentes tipos de colágeno.

Quais são as tarefas e funções da colagenase?
A função das colagenases é quebrar as ligações entre o aminoácido prolina e vários outros aminoácidos. Eles pertencem às proteases, e não às enzimas que quebram as ligações com a ajuda da água.
As colagenases no organismo humano são chamadas de metaloproteases de matriz. Isso significa que eles não são feitos apenas de aminoácidos, mas também têm um íon metálico no centro. No caso das colagenases, é um íon zinco no centro. Com a ajuda desse íon metálico e de uma molécula de água, a ligação entre a prolina e o segundo aminoácido é dividida.
A prolina ocorre em grandes proporções no colágeno, que constitui a maior parte do nosso tecido conjuntivo. É o componente de fibra mais importante em várias estruturas, como pele, ossos e cartilagem.
Devido à função de degradação do colágeno das colagenases, elas são de grande importância na cicatrização de feridas. O tecido danificado ou morto é dividido pela colagenase e, finalmente, dividido. Isso garante a cicatrização ideal da ferida, removendo o tecido morto.
Em humanos, há um total de cinco colagenases que dividem especificamente diferentes colágenos. Eles estão localizados principalmente nos lisossomos, que são responsáveis pela quebra de várias moléculas.
No entanto, as colagenases não são encontradas apenas em humanos, mas também em bactérias. Eles são extremamente importantes para os clostrídios. Essas bactérias usam suas colagenases para destruir o tecido conjuntivo e, assim, conseguir se espalhar melhor no organismo.
Se você tiver mais interesse neste tópico, verifique nosso próximo artigo abaixo: Papel das enzimas no corpo humano
Onde a colagenase é feita?
Como acontece com a maioria das enzimas, a produção de colagenase começa no núcleo da célula. Durante a transcrição, é feita uma cópia de uma seção específica do DNA que contém as informações para essa enzima.
Este mRNA deixa o núcleo da célula através dos poros nucleares e chega ao ribossomo. É aqui que ocorre a tradução e a enzima é montada ligando diferentes aminoácidos.
No entanto, a colagenase ativa não é criada imediatamente, mas um precursor inativo. Essa chamada procolagenase deve ser ativada antes de ser usada.
Essa ativação ocorre após a tradução e apenas quando a colagenase é necessária. Para converter a procolagenase em uma colagenase ativa, uma curta sequência de aminoácidos deve ser cortada.
Este precursor inativo garante um uso controlado das colagenases, caso contrário, elas cumpririam imediatamente sua função de decompor o tecido conjuntivo, mesmo que o tecido seja saudável.
Quais são os níveis normais de colagenase?
Atualmente não existe um valor padrão para a colagenase no organismo humano. Esta enzima é encontrada em muitos órgãos humanos diferentes, como a parte exócrina do pâncreas. Aqui, a colagenase tem a função de reduzir o tamanho dos alimentos.
Se essas células morrerem, por exemplo, no caso de uma inflamação do pâncreas, mais colagenases são secretadas para o sangue. No entanto, não se mede a concentração de colagenase, mas se utiliza outras enzimas, como a lipase neste caso.
Uma razão para isso é a ocorrência generalizada de colagenase. Este fato torna a enzima inespecífica e, portanto, inadequada para análises laboratoriais.
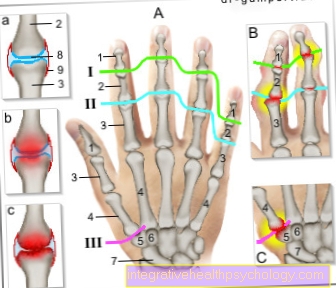
Como funciona na doença de Dupuytren?
A doença de Dupuytren é uma doença associada a um aumento do tecido na área da fáscia palmar da mão. Como resultado, não é mais possível ao paciente esticar totalmente os dedos.
O dedo mínimo é particularmente afetado. Muitas vezes, ela não pode mais ser esticada e fica totalmente na palma da mão. Neste caso, fala-se de contratura em flexão.
Não se sabe como essa doença se desenvolve. Porém, há acúmulo familiar e suspeita-se também de fatores de risco, como fumar cigarros ou álcool.
Os pacientes sofrem de falta de mobilidade das mãos e os vasos e nervos podem ser danificados pela doença de Dupuytren.
Vários procedimentos cirúrgicos estão disponíveis como formas de terapia, como a remoção da aponeurose palmar (Aponeurectomia) ou a divisão da fáscia.
No entanto, também se pode tentar neutralizar a doença com as chamadas injeções de colagenase. As colagenases injetadas devem quebrar o excesso de tecido conjuntivo.
Essas enzimas são injetadas diretamente na fáscia palmar espessada, que é composta em grande parte por fibras de colágeno. Isso afrouxa o tecido e, em seguida, o dedo afetado pode ser esticado o máximo possível.
Se a injeção de colagenase for bem-sucedida, o tecido amolece a tal ponto que o cordão espesso da aponeurose palmar rasga a extensão do dedo e o paciente pode mover a mão normalmente novamente.
Você está mais interessado em outras opções de tratamento para a doença de Dupuytren? Leia nosso próximo artigo abaixo: Terapia da doença de Dupuytren
Recomendações da equipe editorial
Outras informações gerais também podem ser do seu interesse:
- Enzimas pancreáticas
- Colágeno
- tecido conjuntivo
- A alfa amilase
- Doença de Dupuytren